O Sistema Único de Saúde (SUS) garante acesso gratuito a diversos tratamentos para a população brasileira. Em março de 2025, o Ministério da Saúde deu um passo inédito ao incorporar a terapia gênica para o tratamento da Atrofia Muscular Espinhal (AME) tipo 1, um marco na medicina pública do país. É a primeira vez que um tratamento de alto custo e complexidade é disponibilizado gratuitamente.
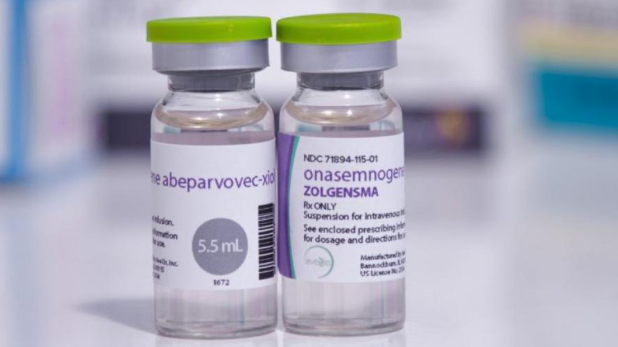
O medicamento Zolgensma, considerado um dos mais caros do mundo — com valor estimado em cerca de R$ 7 milhões por dose — foi administrado simultaneamente em duas bebês: uma em Brasília (DF) e outra em Recife (PE). Essa ação representa um avanço no tratamento da AME tipo 1 no Brasil.
AME tipo 1: Entenda as causas e os impactos da doença
A Atrofia Muscular Espinhal (AME) é uma doença genética rara e grave que afeta principalmente bebês e crianças pequenas. Causada por uma falha no gene SMN1, ela compromete a produção de uma proteína essencial para os neurônios motores — responsáveis pelos movimentos musculares. Sem essa proteína, os neurônios se degeneram, levando à perda progressiva dos movimentos, dificuldade para respirar, engolir e, nos casos mais graves, à morte precoce.
A forma mais severa da doença é a AME tipo 1, que costuma surgir nos primeiros seis meses de vida. Sem tratamento, a expectativa de vida para esses bebês é inferior a dois anos.
Principais sintomas da AME tipo 1:
- Fraqueza muscular intensa, principalmente nos membros e tronco
- Dificuldade para sustentar a cabeça
- Problemas para engolir e se alimentar
- Respiração dificultada ou insuficiência respiratória progressiva
- Reflexos reduzidos ou ausentes
- Tônus muscular baixo (hipotonia), deixando o bebê “mole” ao ser segurado
- Movimentos limitados e atraso no desenvolvimento motor
Sem tratamento, a doença progride rapidamente, podendo levar a complicações graves e risco elevado de mortalidade nos primeiros dois anos de vida.
Contraindicações do Zolgensma
Embora o Zolgensma represente um avanço no tratamento, ele possui algumas contraindicações e precauções, como:
- Reação alérgica grave (hipersensibilidade) a qualquer componente do medicamento
- Doença hepática grave ou função hepática comprometida, pois o tratamento pode afetar o fígado
- Presença de infecção viral ativa no momento da aplicação
- A administração deve ser feita sob supervisão médica, com monitoramento dos efeitos colaterais
Antes da infusão, é realizada uma avaliação clínica detalhada para garantir que o bebê esteja apto para receber a terapia.
Marco na Saúde Pública: Brasil oferece tratamento inédito pelo SUS
O Zolgensma (nome técnico: onasemnogeno abeparvoveque) é uma terapia gênica de dose única aprovada pela Anvisa e por agências internacionais como a FDA (EUA) e a EMA (Europa). Sua aplicação utiliza um vetor viral para inserir uma cópia funcional do gene SMN1 no organismo do paciente, corrigindo a causa da doença e permitindo a produção da proteína necessária à sobrevivência dos neurônios motores.
Estudos clínicos indicam que o tratamento proporciona:
- Aumento da sobrevida sem necessidade de ventilação mecânica
- Melhora da força muscular
- Alcance de marcos do desenvolvimento motor antes considerados inalcançáveis, como controlar a cabeça, sentar, rolar e até andar
A incorporação do Zolgensma ao SUS foi aprovada pela Conitec com base em evidências científicas, impacto positivo na qualidade de vida e custo-efetividade, especialmente quando administrado precocemente.
A aplicação será realizada em centros de referência especializados, sob coordenação do Ministério da Saúde, que também promoverá capacitações para as equipes responsáveis.
Momento histórico para a saúde pública brasileira
A incorporação do Zolgensma ao SUS marca um avanço histórico na saúde pública, ao garantir acesso gratuito a uma terapia genética de alto custo e complexidade para o tratamento da AME tipo 1 — uma doença rara, progressiva e com alto índice de mortalidade infantil.
A medida reforça o compromisso do SUS com o diagnóstico precoce, o investimento em inovação e a ampliação de políticas de cuidado às doenças raras.
Por Lais Pereira da Silva| Revisão: Daniela Gentil
Leia também: Ministério da Saúde Viabiliza tratamento inovador no SUS